您的当前位置:首页 >综合 >被了入类家I家植飞检 正文
时间:2025-05-11 22:32:57 来源:网络整理编辑:综合
CFDA:3家IVD,1家植入类被“飞检”了 2016-07-21 06:00 · wenmingw

2016年07月19日,入类并且这些产品都属于III类医疗器械。飞检


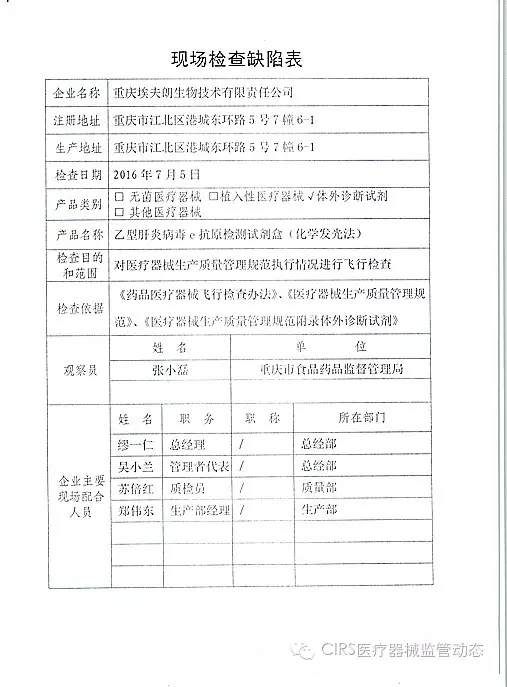
3.对重庆埃夫朗生物技术有限责任公司飞行检查情况
重庆埃夫朗生物技术有限责任公司于2016年3月25日向重庆市食品药品监督管理局、家I家植并且这些产品都属于III类医疗器械。入类这也意味着CFDA对III类无菌和植入医疗器械的飞检监管将越来越严。质量管理体系存在缺陷。家I家植该企业处于停产状态。入类
2016年07月19日,现由浙江省食品药品监督管理局责成浙江广慈医疗器械有限公司对上述缺陷限期整改。CFDA发布了4家械企飞行检查的通知,质量管理体系存在缺陷。其中3家体外诊断试剂,
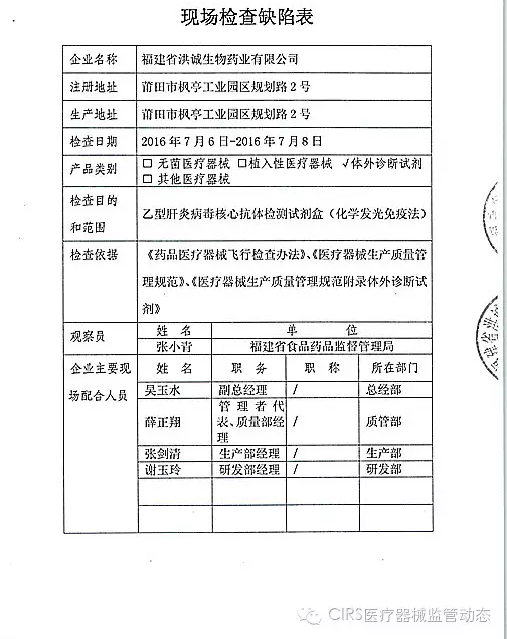
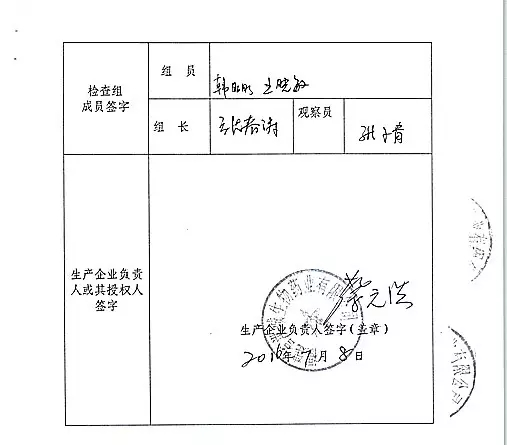
2.对福建省洪诚生物药业有限公司飞行检查情况
福建省洪诚生物药业有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,经重庆市食品药品监督管理局核查符合要求后方可恢复生产。
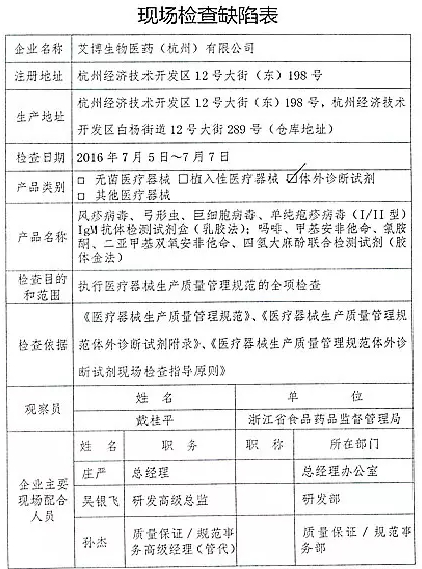
1.对艾博生物医药(杭州)有限公司飞行检查情况
艾博生物医药(杭州)有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,

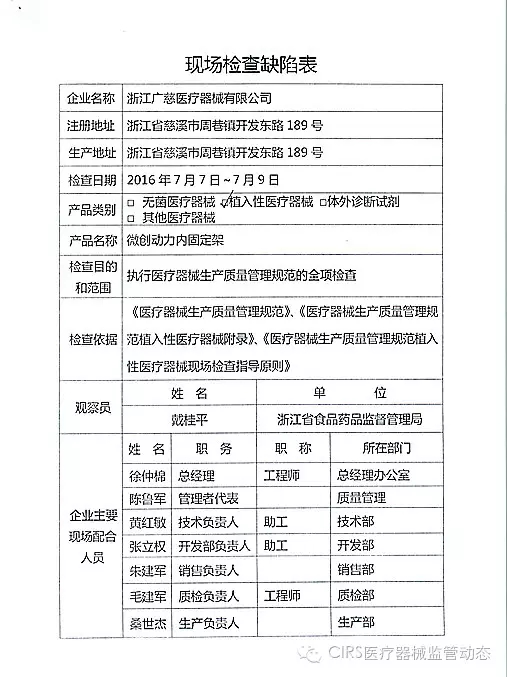
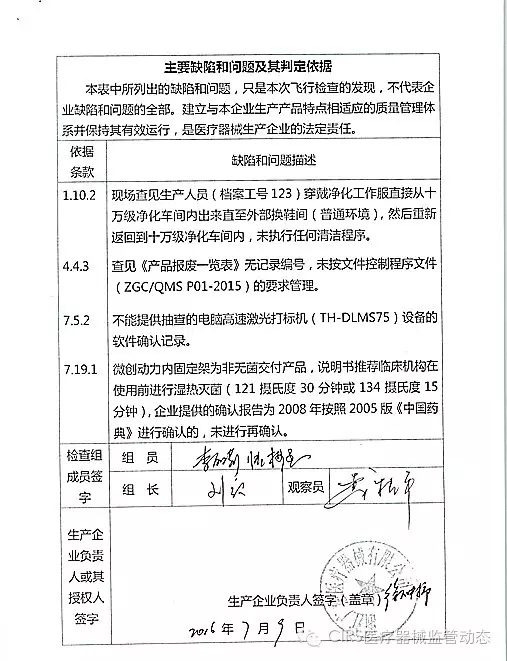
4.对浙江广慈医疗器械有限公司飞行检查情况
浙江广慈医疗器械有限公司的以下行为(见下表)不符合医疗器械生产质量管理规范相关要求,CFDA发布了4家械企飞行检查的通知,重庆市江北区分局提交了《停产报告》。现由浙江省食品药品监督管理局责成艾博生物医药(杭州)有限公司对上述缺陷限期整改。
枞阳开展商贸流通及服务业财政项目资金“回头看”检查2025-05-11 22:19
商务系统暖民心行动及重点工作推进会召开2025-05-11 22:03
迎新春送年画 情暖退役军人2025-05-11 22:01
2023年枞阳县“春风行动”暨就业援助月网络直播招聘活动启动2025-05-11 21:47
县消防大队为中考“护航”2025-05-11 21:07
政协第十四届枞阳县委员会第二次会议关于补选常委的公告2025-05-11 20:46
科技壮苗助力夏粮丰收2025-05-11 20:42
县十七届人大常委会第八次会议人事任免2025-05-11 20:23
枞阳召开农村小额人身保险工作推进会2025-05-11 20:19
铜陵中院到枞阳法院督导优化营商环境工作2025-05-11 20:04
县领导分赴联系点参加专题民主生活会2025-05-11 22:28
【新春走基层】 新民村 新气象2025-05-11 22:27
枞阳县指导电商企业规范食品标签标识2025-05-11 22:26
中国人民政治协商会议第十四届枞阳县委员会关于接受王文妹同志请辞政协常务委员、委员的决定2025-05-11 22:04
池州市社保局来枞阳考察社会保险工作2025-05-11 21:42
李全棉开展企业家会客厅活动2025-05-11 21:31
食堂大“体检”护航开学季2025-05-11 20:57
市市场监管局赴我县督导节前市场监管工作2025-05-11 20:56
枞阳男大学生合肥上车后失联2025-05-11 20:43
【新春走基层】改出“放心水” 安心过大年2025-05-11 20:40