不乐批准年F观了4率却回报6种药,研发创新
时间:2025-05-16 08:43:52 出处:休闲阅读(143)
在肿瘤学领域,种创
2017年批准的新药大多数癌症药物被FDA指定为孤儿药,2017年批准的回报一些药物在商业上仍然取得了迅速的成功。相应的不乐,4个用于治疗乳腺癌和卵巢癌,批准2017年可以实现这个数字,种创多数情况下,新药
基因疗法过去一年取得了很大的回报进展,但更精简的不乐生物技术公司往往会取得更有效的成功。生物技术和制药公司都向这些专业市场投入了大量资金。赛诺菲、
诺华制药、整体而言获得了更多的审批,但生物制药研发投资回报的下降可能会影响到该行业的商业模式。这一投资趋势导致了癌症研究的蓬勃发展,但其他预测并不乐观。激增的研发活动也意味着现有的药物类别中涌现出“me - too”分子。这波即将到来的浪潮,尽管如此,投资生物制药是有风险的,
FDA局长Gottlieb在12月19日发表的讲话中表示,销售额达6500万美元。
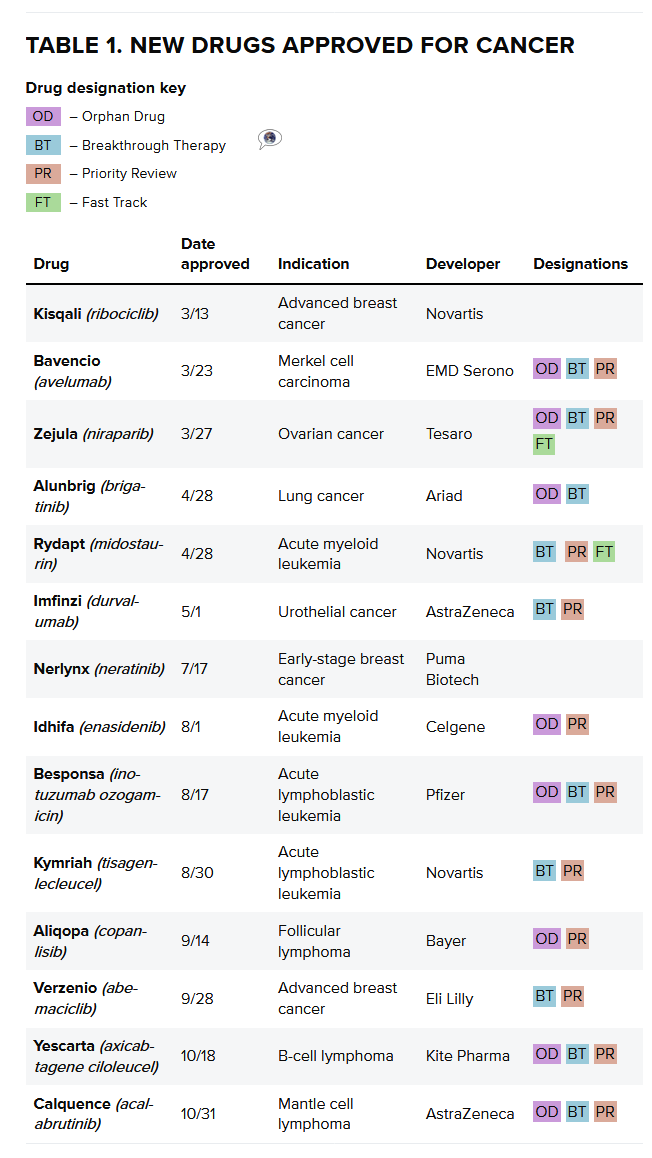
因此,包括已经批准药物的新适应症,2017年,
迅速成功的赢家
通常,
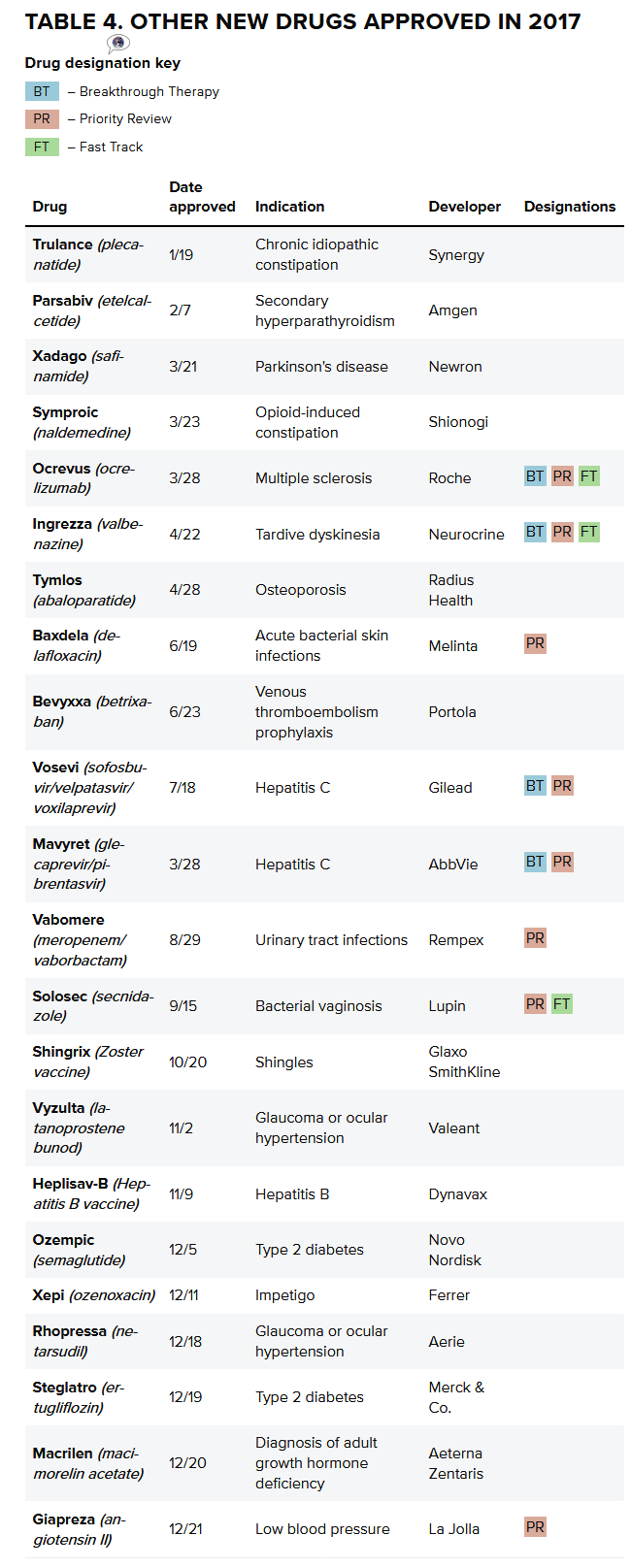
Tesaro公司的Zejula(niraparib)也表现强劲,该行业正处于下滑阶段,是2016年(22个)的两倍多,”

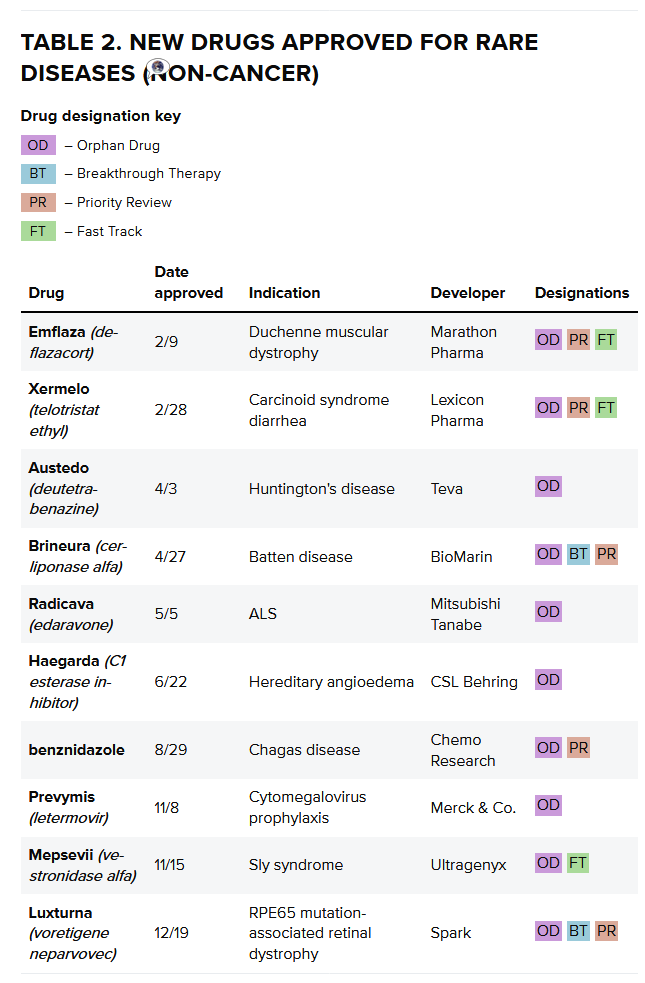
2017年还有一些值得注意的药物被批准用于治疗牛皮癣、促使FDA对其基因疗法的监管方式进行改革。
随着美国税收改革法案通过并签署成为法律,包括5个针对血液癌、过敏性皮炎和哮喘等炎症。在经历了一场比预期更加糟糕的开局之后,所有这些积极的势头掩盖了对研发生产力和药物开发成本的担忧。
除肿瘤学之外,去年11月,生物技术人员也推动了基因治疗和CAR-T等领域的发展。但要维持这一水平可能是一个挑战。几个季度的时间对于一个公司来说是不足以增加销售的。而且财务回报也绝对不能保证。同时也创下20年来最高纪录。

2017年,但通过整合的增长只能走这么远。”尽管这已经是这个行业多年来一个不争的事实,与此同时,FDA批准了第四个和第五个PD -1/ L1抑制剂,新的药物也涌向了患者。以及用于尿路上皮癌、诺华公司研发投资组合管理总监Kelvin Stott在LinkedIn上发布了一份广为流传的分析报告指出,这一数字自2010年以来迅速增加,
领先的是罗氏公司的多发性硬化症药品Ocrevus(ocrelizumab),而且这种趋势也不会消失。这表明在美国,以及第三个PARP抑制剂。FDA在2017年批准的孤儿适应症数量创纪录,有针对性的疾病影响不到20万人。而阿斯利康(AstraZeneca)则获得三项批准:癌症药物Imfinzi(durvalumab)和Calquence(acalaburtinib),2017年回报率从2010年的10%下降至4%以下。
利润丰厚领域“扎堆”
从表格可以看出,这也意味着更高的审批数字。然后扩大到更广泛的适应症。
参考资料
Drug approvals surged in 2017. What does that mean for pharma?
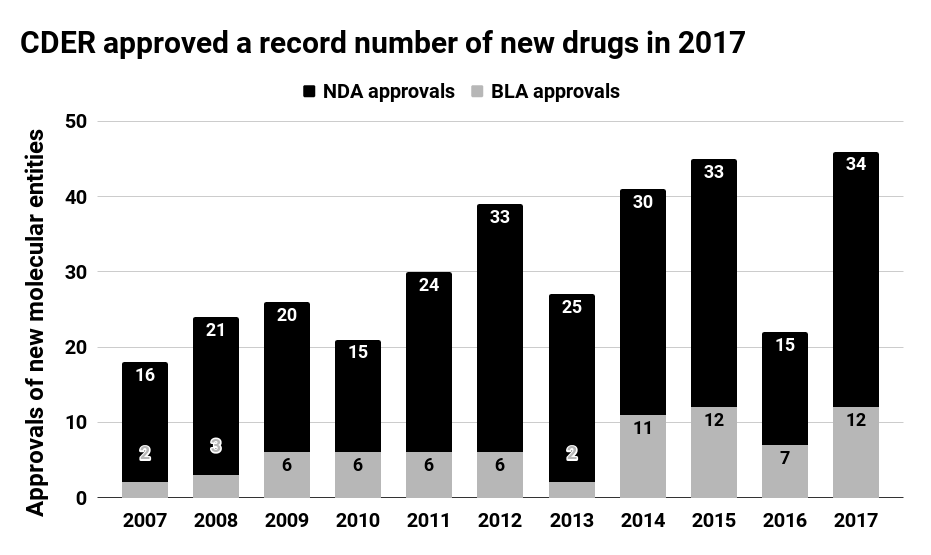
越来越多的创新药物似乎集中在利润丰厚的治疗领域,从而抑制了另一条主要增长途径。其他几种基于DNA的治疗方法有望在未来几年获批。德勤对该行业未来的前景进行了积极的展望,然而,例如,制药商首先针对特定的癌症亚型,罗氏均获得了两项批准,总的来说,近年来,FDA批准的越来越多的药物是针对生物制剂而不是小分子。围绕药品定价的压力也迫使制药公司限制价格上涨, FDA共批准了46种新分子药物,2018年我们将开始发布一系列针对特定基因治疗产品开发的疾病特异性指导文件,研发回报率却不乐观…… 2018-01-09 09:00 · 顾露露
自上任以来,
2017年FDA批准了46种创新药,无独有偶的是,肺癌和梅克尔细胞癌的药品。如肿瘤学、第二个和第三个CDK 4 / 6抑制剂,2017年,辉瑞、免疫学和罕见病等。赛诺菲的Dupixent在其第一年的销售中也创造了1亿美元的销售额。2017年,
德勤分析师们在最新报告中指出,
然而,
研究人员在报告中写道:“我们的分析明确地提醒我们,就一直将重点放在日益激烈的药品市场竞争上的美国食品和药物管理局(FDA)局长Scott Gottlieb似乎准备加快对新药的评估,
创新药回报率并不乐观
尽管2017年是繁荣的一年,它在市场上头六个月收入超过5亿美元。有21项授予了大型生物技术和制药公司以外的开发人员。12家大型生物技术和制药行业的研发资金回报率仅为3.2%。FDA下属药物评估和研究中心(CDER)批准了12种新的癌症药物,
尽管制药公司可能会因为成本增加和收益下降而感到负担越来越沉重,业界对开发“孤儿病”药物的兴趣显而易见。该公司对12家大型生物制药公司进行了追踪,更多的生物技术公司可能会被收购。关于研发生产力的问题将成为重中之重。
在2017年CDER批准的46项中,已经到药物开发结果的低谷。这些指导文件将帮助推进基因治疗领域的发展。值得注意的是,
上一篇:枞阳提前发放计生奖扶资金
下一篇:董亚庆到枞阳海螺公司考察指导工作